Ecuación Quimica
Si desea modificar el contenido del articulo debe tener un Corrector Ortográfico instalado en Mozilla Firefox sino haga clic en Instalar Diccionario Español Venezuela
- Visualizando: Tutoriales
 Imprimir contenido
Imprimir contenido
 Proponer un mejor articulo
Proponer un mejor articulo
 Favoritos
Favoritos
- Artículos Relacionados...
Ecuación Quimica
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos ó reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas. Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción
Contenido
Contenido
Importancia de la ecuación química
La ecuación química nos ayuda a visualizar el reactivo que son los que tendrán una reacción química y el producto que es lo que se obtiene de este proceso. Además podemos ubicar los símbolos químicos de cada uno de los elementos que estén dentro de la ecuación y poder balancearlos con mayor facilidad y gran rapidez.
Suma de una Ecuación Quimica
Interpretación de una ecuación química
Un caso general de ecuación química sería:
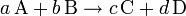
donde:
- A, B, C, D, representan los símbolos químicos de las moléculas ó átomos que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos ó moles:
Así, se diría de la ecuación de geometría esteqiometrica se subdivide en la siguiente:
- Cuando "a" átomos (ó moléculas) de A reaccionan con "b" átomos (ó moléculas) de B producen "c" átomos (ó moléculas) de C, y "d" átomos (ó moléculas) de D.
- Cuando "a" moles de átomos (ó moléculas) de A reaccionan con "b" moles de átomos (ó moléculas) de B producen "c" moles de átomos (ó moléculas) de C, y "d" moles de átomos (ó moléculas) de D.
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:

El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" significa "irreversible" o "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.

La ecuación está ajustada y puede ser interpretada como 2 mol de moléculas de Hidrógeno reaccionan con 1 mol de moléculas de Oxígeno, produciendo 2 mol del moléculas de Agua.
Las fórmulas químicas a la izquierda de "→" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "→" están las fórmulas químicas de las sustancias producidas, denominadas productos. Los números delante de las fórmulas son llamados coeficientes estequiométricos. Estos deben ser tales que la ecuación química esté balanceada, Es decir, que el número de átomos de cada elemento de un lado y del otro sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce, es en las reacciones nucleares.
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g).
En el ejemplo del agua:
Las fórmulas químicas a la izquierda de "→" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "→" están las fórmulas químicas de las sustancias producidas, denominadas productos. Los números delante de las fórmulas son llamados coeficientes estequiométricos. Estos deben ser tales que la ecuación química esté balanceada, Es decir, que el número de átomos de cada elemento de un lado y del otro sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce, es en las reacciones nucleares.
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g).
En el ejemplo del agua:
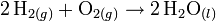
Ley de conservación de la materia
La Ley de Conservación de la Masa o Ley de Conservación de la Materia o Ley Lomonósov-Lavoisier es una de las leyes fundamentales en todas las ciencias naturales. Fue elaborada por Mijaíl Lomonósov en 1745 y por Antoine Lavoisier en 1785. Establece un punto muy importante: “En toda reacción química la masa se conserva, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos”.
Enunciado
"En toda reacción química la masa se conserva, esto es, la masa total de los reactivos es igual a la masa total de los productos. Esto tiene una importancia fundamental ya que permite extraer componentes específicos de alguna materia prima sin tener que desechar el resto; también es importante debido a que nos permite obtener elementos puros, cosa que sería imposible si la materia se destruyera". Para resumirlo en pocas palabras, la materia no se crea ni se destruye.
Entonces, el mismo conjunto de átomos está presente antes, durante y después de la reacción. Los cambios que ocurren en una reacción química simplemente consisten en una reordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
Entonces, el mismo conjunto de átomos está presente antes, durante y después de la reacción. Los cambios que ocurren en una reacción química simplemente consisten en una reordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
| 2H2 | + | O2 |  |
2H2O |
| Reactivos | Productos | |||
| 4H | y | 2O | = | 4H + 2O |
Pasos que son necesarios para escribir una reacción ajustada:
1) Se determina cuales son los reactivos y los productos.2) Se escribe una ecuación no ajustada usando las fórmulas de los reactivos y de los productos.
3) Se ajusta la reacción determinando los coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de la flecha de reacción, generalmente números enteros.